亏损收窄、资金充裕,探讨健世科技-B(9877.HK)年报背后未来增长引擎
全球化战略,是高端创新医疗器械企业发展蓝图中的必选项。
据国金证券研究显示,2022年全球医疗器械市场规模约5700亿美元,其中中国医疗器械市场规模占比仅约为23.3%,而北美、欧洲等发达国家地区则占据更多比重。因此,国内企业若想拓展更大的市场空间,必然要着眼海外。
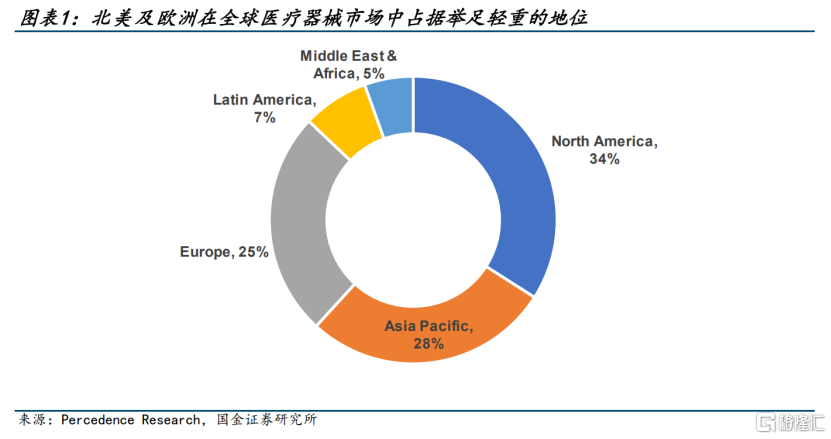
资料来源:国金证券
同时,借鉴全球医疗器械巨头的发展经验来看,美敦力作为美股医疗器械公司中上市后带给投资者年化收益率最高的企业之一,其自1980年上市以来,海外市场的收入占比就持续增长,由2002年的30.6%上升至2023年的47.6%,新兴市场的贡献尤为显著。这一趋势足以表明,海外市场的拓展对公司的快速壮大起到了关键作用。
在近期的港股年报季中,笔者就留意到有一家企业,目光自始至终都是全球市场,并在过去一年里呈现出许多不容忽视的积极变化。
近日,健世科技发布2023年财报,归母净亏损为3.72亿元,同比收窄15.4%;账面货币资金为 9.28亿元,同比增长27.6%。
两大核心数据的改善主要得益于公司对成本和开支的严格管理,以及通过出售前期的财务投资股权所获得的资金回款。同时,充沛的资金储备不仅能够满足公司日常运营的资金需求,还能够为公司未来的持续研发活动和产品商业化提供坚实的财务支持。
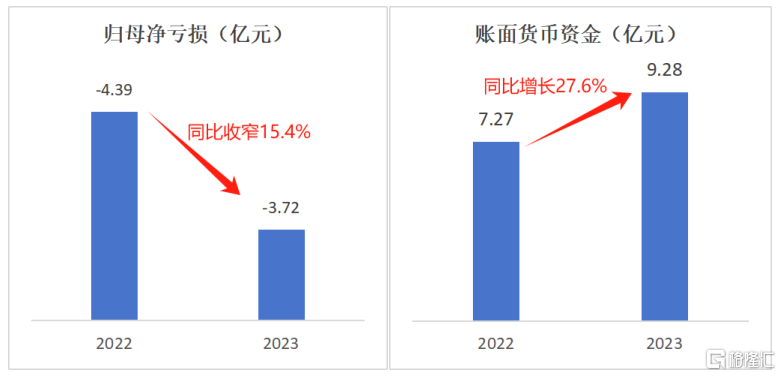
数据来源:财报
透过财报可以看到,健世科技在自主研发创新产品方面的持续深耕,已经迎来了多个产品的临床进展,并有数款产品正处于上市注册的关键阶段,预示着其即将进入一个硕果累累的收获期。
将视角拉长,笔者认为,健世科技当前的全球化临床进展,以及商业化准备活动为其铺设了一条坚实的增长之路,或为投资者揭示了其后续价值密集爆发的潜能。不妨来进一步探讨。
1、全球商业化持续演绎,核心产品经导管三尖瓣介入置换系统LuX-Valve系列产品将成为公司未来增长爆发点
丰富的管线组合,不仅为健世科技的全球化战略提供了坚实的基础,而且也为其未来的市场拓展和业务增长注入了强大的动力。
聚焦于结构性心脏病介入医疗器械领域,健世科技目前已经开发出针对三尖瓣疾病、主动脉瓣疾病、二尖瓣疾病、心力衰竭及心源性卒中等不同类型结构性心脏病的一系列治疗解决方案。
健世科技当前的重点任务之一,就是核心产品经导管三尖瓣介入置换系统LuX-Valve系列产品的临床和商业化推进,目前已在全球范围内取得亮眼成绩,并获得高度赞扬和广泛关注。
具体到细节上,公司的核心产品经导管三尖瓣介入置换系统LuX-Valve系列产品具有全球首创的“室间隔锚定”和非径向支撑力的设计理念,是为治疗有重度三尖瓣反流及高手术风险的患者而设计。
在国内市场,目前公司正在积极推进LuX-Valve上市注册进程。LuX-Valve Plus作为第二代经导管三尖瓣置换系统,目前已完成确证性临床试验入组和注册临床6个月期的随访,预计也将于近期递交上市注册申请。
另外,公司的第一代经导管主动脉瓣介入置换系统Ken-Valve的上市注册申请已获NMPA正式受理。值得一提的是,Ken-Valve已获选进入国家药监局的医疗器材优先审批程序,是国内首个进入优先审批程序的瓣膜类产品;经导管二尖瓣修复夹持系统JensClip已完成确证性临床试验全部入组以及一个月期随访。公司正在有条不紊全面推进各款结构性心脏病产品的研发与临床。
值得一提的是,LuX-Valve Plus在海外的进展尤其亮眼,预计2024年将有多个里程碑事件出现。
通过在全球多个国家和地区积极开展注册临床试验、获取市场准入批准、扩大业务覆盖范围以及建立战略合作伙伴关系等多元化策略,为该系列产品的全球商业化奠定了坚实的基础。同时,公司也能借助这一系列产品的成功经验,为后续其他产品线的海外推广铺平道路。
从临床数据上来看,LuX-Valve和LuX-Valve Plus也均显示出良好的有效性和安全性,得到海内外专家高度赞扬和关注。
例如,在2023年伦敦心脏瓣膜病介入治疗会议(PCR London Valves)上,LuX-Valve一年期临床数据显示,在有效性方面99.1%的患者三尖瓣反流等级降低至中度及以下,79.8%的患者由术前NYHA心功能等级III/IV级改善至I/II级。在安全性方面,一年期全因死亡率为10.32%(FAS,PPS为9.6%);肾功能和肝功能衰竭发生率分别为4.0%和2.4%,III度房室传导阻滞或需要安装永久性起搏器发生率仅为1.6%,数据显示患者术后并发症低,安全性得到有效验证。
在2023年美国经导管心血管治疗大会(TCT)上,LuX-Valve Plus一个月期临床数据显示,器械成功率和手术操作成功率均高达96.84%;疗效性上,所有患者三尖瓣反流降低至轻度及以下,逾80%的患者心功能及生活素质由术前的NYHA III/IV级提升至I/II级;安全性上,复合事件发生率仅为6.45%。
按各地区进展来看,在欧洲,LuX-Valve Plus在欧洲的以获得CE认证为目标的临床试验受试者入组环节已经接近尾声,得到包括法国、德国、西班牙、丹麦等国家的临床中心积极参与,获得参与临床中心的一致好评。同时,LuX-Valve Plus获选加入由欧洲药品管理局(EMA)发起的欧洲临床专家委员会科学建议试点(Expert Panel Scientific Advice Pilot),也将提升该产品在欧洲地区的CE认定临床试验和未来商业化拓展进度和确定性。
在美国,LuX-ValvePlus在美国正式后动试验性器械豁免(IDE)申请的准备工作。LuX-Valve Plus的早期可行性研究(EFS)的预申请获得FDA正式受理,同时正式启动了在美国的试验性器械豁免(IDE)申请的准备工作,预计2024年第四季度完成EFS临床研究并进入IDE临床试验准备阶段。同时,LuX-Valve Plus获选加入FDA产品全生命周期咨询计划,将提升该产品在美国的临床试验和商业化拓展进度和确定性。
在北美及亚太地区,公司的经导管三尖瓣介入置换系统LuX-Valve Plus已完成一系列商业化准备活动,产品商业化能力已初显。为满足全球三尖瓣反流患者庞大、急迫的治疗需求,公司计划在全球范围内陆续拓展产品的商业化准备活动,进一步提升公司的学术地位和商业化影响力,并为未来的全球商业化推广夯实基础。
在拉丁美洲,LuX-Valve Plus在巴西完成首例临床植入手术,进一步扩大产品推广范围。本次应用是经导管三尖瓣介入治疗术式在拉丁美洲的首次应用,得到术者的高度认可 。
可以判断,若日后这两款产品顺利在全球市场商业化并应用,预计将进一步填补市场上未被满足的患者需求,极大地改善患者的治疗效果和生活质量。
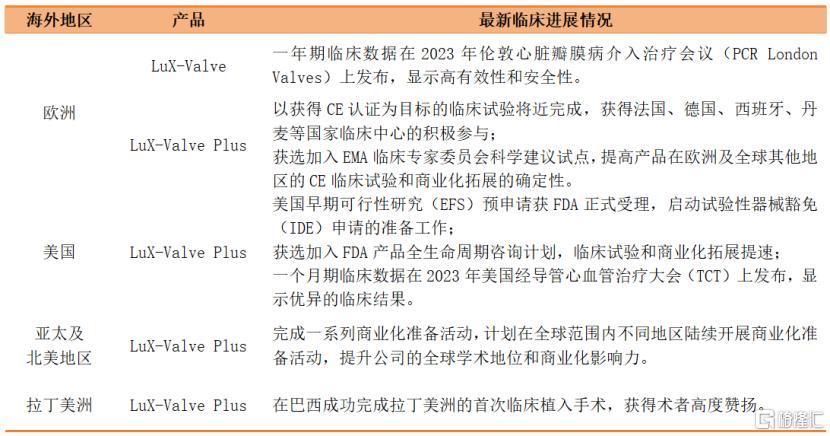
资料来源:财报
海内外的一系列积极进展,不仅彰显出健世科技在国际医疗器械领域的影响力和竞争力,也体现了公司战略规划和执行能力的成熟。日后,随着这些产品顺利在全球市场上市,也将会为公司带来多元化的收入来源,有助于分散市场风险,增强财务稳定性。
2、极致运营强化市场影响力,助力商业化兑现提速
然而,健世科技深知,创新医疗器械产品的上市并不是结束,而是商业化旅程的起点,其后的市场推广和运营工作对于产品的商业化兑现至关重要。
为此,公司已经建立了一支高效专业的商业化团队,专注于核心产品的市场导入和教育培训工作,确保产品上市后能够迅速占领市场。
财报显示,在国内市场,健世科技的LuX-Valve系列产品已在超过220家具有学术和行业影响力的医院得到推广,覆盖了全国30多个省、直辖市及自治区,同时培养了50多位能够独立操作的医生和带教术者。在国际市场,LuX-Valve Plus也在北美、欧洲、亚太等地区的近50家知名医院成功实施了植入手术或疗法推广,并累计培养了24位独立医生和带教术者。

资料来源:公司资料
此外,公司积极参加国内外的行业大会和学术会议,如2023年伦敦心脏瓣膜病介入治疗会议、2023年美国经导管心血管治疗大会、海峡两岸心血管介入治疗研讨会、2023成都国际心脏瓣膜病介入治疗会议、杭州瓣膜会及西部瓣膜论坛等。
这些高品质的学术交流平台,不仅增强了公司产品的全球认可度,也为公司的全球商业化推广提前布局了医院、医生、销售网络、供应链和潜在合作伙伴等关键资源。

资料来源:公司官网
通过这些努力,健世科技不断提升自身的商业化运营能力,强化市场影响力,为产品的商业化兑现提速提供了坚实的基础。这不仅有助于公司在激烈的市场竞争中站稳脚跟,也为公司的长期发展和持续增长注入了强大的动力。
3、小结
从健世科技的这份年报中不难看出,持续收窄的亏损表现、充沛的资金储备,展现出过去一年公司财务水平的持续改善。同时,公司在全球化商业化布局方面的积极进展,也已清晰描绘出其未来的发展路径。
随着后续产品在全球市场的陆续上市,健世科技有望快速实现商业价值的兑现,这一增长势头也预计将会在资本市场上得到反映。作为投资者,我们或许给其多一些耐心和关注。
交易商排行
更多- 监管中EXNESS10-15年 | 英国监管 | 塞浦路斯监管 | 南非监管89.42
- 监管中FXTM 富拓10-15年 |塞浦路斯监管 | 英国监管 | 毛里求斯监管85.36
- 监管中GoldenGroup高地集团澳大利亚| 5-10年85.87
- 监管中金点国际集团 GD International Group澳大利亚| 1-2年86.64
- 监管中Moneta Markets亿汇澳大利亚| 2-5年| 零售外汇牌照80.52
- 监管中IC Markets10-15年 | 澳大利亚监管 | 塞浦路斯监管91.71
- 监管中CPT Markets Limited5-10年 | 英国监管 | 伯利兹监管91.56
- 监管中GO Markets高汇15-20年 | 澳大利亚监管 | 塞浦路斯监管 | 塞舌尔监管87.90
- 监管中alpari艾福瑞5-10年 | 白俄罗斯监管 | 零售外汇牌照87.05
- 监管中AUS Global5-10年 | 塞浦路斯监管 | 澳大利亚监管86.47


